腸内細菌と妊活の意外な関係とは?
最近の研究で、私たちの体の中に住んでいる小さな微生物たち(腸内細菌など)が、健康にとても大切な役割を果たしていることがわかってきました。
人の体には、腸だけでなく、口の中・皮膚・膣などにも無数の微生物がすんでいます。
これらの微生物の集まりを 「マイクロバイオータ(microbiota)」 と呼び、その遺伝情報や活動まで含めた“生態系としての全体像”を「マイクロバイオーム(microbiome)」と呼びます。
特に、腸内のマイクロバイオームと、女性の体の中(膣や子宮)にいる細菌たちは、体の調子を整えたり、ホルモンバランスを保ったりする重要な働きをしています。
そして驚くことに、これらの小さな味方たちが、妊娠のしやすさや不妊治療の成功にも関係していることが明らかになってきたのです。
この記事では、最新の研究結果をもとに、腸内細菌と妊活・体外受精などの治療がどのように関係しているのかを解説します。
なぜ腸内細菌が妊娠と関係するの?
腸内細菌と妊娠の関係を理解するために、まずは基本的なしくみを見てみましょう。
腸と生殖器官の「つながり」
腸内の良い細菌たちは、食物繊維を食べて炎症を抑える物質や免疫を整える物質を作り出します。しかし、腸内細菌のバランスが崩れると、体に悪い物質が血液に入り込み、
全身に「軽い炎症」が生じることがあります。
そこで重要なキーワードとなるのが「ディスバイオーシス(dysbiosis)」=腸内細菌バランスの乱れです。
ディスバイオーシスは
- ストレス
- 不規則な生活
- 高脂肪食品の多い食事
- 抗生物質の使用
などで起こり、次のような影響を与えます。
- 女性ホルモンのバランスの乱れ
- インスリン抵抗性
- 免疫の過剰反応
- 卵巣機能の低下
- 子宮内膜の炎症
これらが積み重なることで、妊娠のしやすさに影響してしまうというわけです。
この関係性は 「腸―生殖器官軸(gut–reproductive axis)」 と呼ばれています。
◆ 生活習慣も腸内環境を左右する
研究では次のようなことが分かっています。
A. 健康的な生活習慣はプラスに働く
- 定期的な運動
- 食物繊維の多い食事
これらは腸内マイクロバイオームを整え、炎症を抑え、ホルモンバランスを良好に保ちます。
B. 不健康な生活習慣はマイナスに働く
- 座りっぱなしの生活
- 高脂肪・高糖質の食事
これらはディスバイオーシスを招き、炎症を増やしてしまいます。
C. 妊娠中の炎症はリスク
妊娠中の慢性的な炎症は
- 妊孕性の低下
- 流産
- 早産
などの可能性を高めることも報告されています。
(出典:Xiao L, et al. Genomics Proteomics Bioinformatics. 2024)
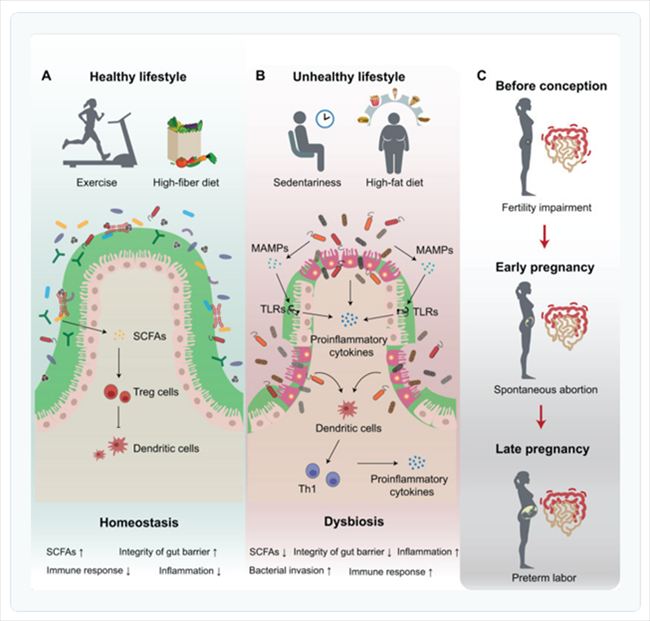
- 健康的な生活習慣の影響: 定期的な運動や高繊維食などの活動的な生活習慣は、腸内マイクロバイオームの恒常性を保ち、腸管バリア機能を維持し、SCFAの産生を増加させます。これにより炎症性サイトカインの産生が抑制され、免疫応答が適切に調節されることで、生殖健康の維持に寄与します。
- 不健康な生活習慣の影響: 座りがちな生活や高脂肪食などの不健康な生活習慣は、腸内マイクロバイオームを乱し、腸管バリア機能を損ないます。病原体の侵入が免疫細胞を刺激し、炎症性サイトカインの産生を増加させることで、免疫応答が活性化し、生殖関連の様々な疾患を引き起こす可能性があります。
- 妊娠中の持続的炎症: 妊娠各期における腸内の持続的な炎症は、妊孕性の低下、自然流産、早産などの有害な妊娠転帰を誘発する可能性があります。
出典: Xiao L, et al. Genomics Proteomics Bioinformatics. 2024.
女性の体にとって大切な「乳酸菌」の話
以前は子宮の中には細菌がいないと思われていましたが、最新の技術で調べてみると、実は少量の細菌が住んでいることがわかりました。特に、膣から子宮にかけての環境では、乳酸菌(ラクトバチルス)がたくさんいる状態が「健康な状態」の目安とされています。
乳酸菌は、その名前の通り乳酸を作って膣の中を酸性に保ち、さらに殺菌作用のある物質も作ることで、悪い細菌が増えるのを防いでくれます。この乳酸菌が少なくなって他の細菌が増えすぎると、細菌性膣症などの病気を引き起こし、炎症が起こって、受精や着床、妊娠の継続に悪い影響を与える可能性があると考えられています。
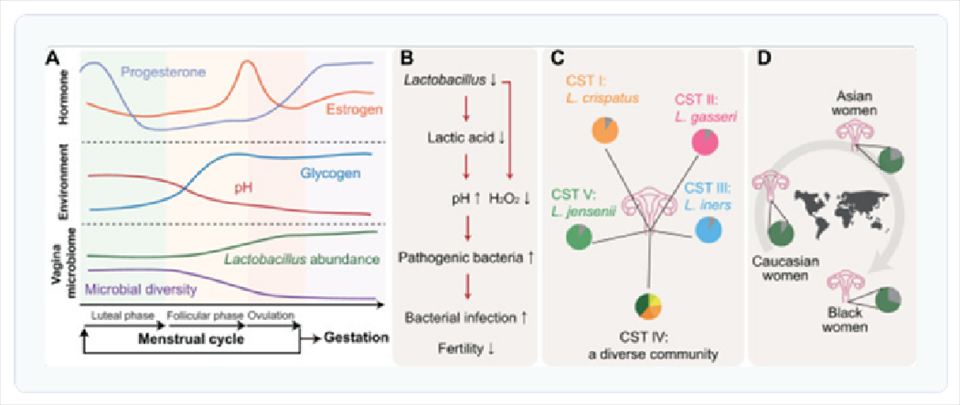
- 妊娠前後のホルモンとマイクロバイオームの変化: 卵胞期が始まるとエストロゲンとプロゲステロンのレベルが上昇します。これらのホルモンの変動は、腟内環境と微生物叢に変化をもたらし、ラクトバチルス属の存在量が増加し、腟のpHと微生物の多様性が低下することで、受胎に適した環境が作られます。
- 妊孕性におけるラクトバチルスの役割: ラクトバチルスの減少は、腟内の乳酸およびH₂O₂レベルの低下に関連し、環境のpH上昇と病原性細菌の過剰増殖につながります。これが細菌性腟症(BV)や不妊症を誘発することがあります。
- 腟内の5つのCST(Community State Type): 腟内微生物叢は、優勢な菌種によって主に5つのタイプに分類されます。CST I, II, III, Vはラクトバチルス属が優勢ですが、CST IVは多様な微生物群集で構成されます。
- ラクトバチルス割合の人種差: 限られた研究に基づくと、北米の健康な白人女性の多くはラクトバチルス属が優勢ですが、アジア系や黒人女性ではその割合が低い傾向があると報告されています。ただし、これにはさらなる検証が必要です。
出典: Xiao L, et al. Genomics Proteomics Bioinformatics. 2024.
具体的な研究結果と実際の治療での活用
これらの基本的なしくみを踏まえて、最近の研究では具体的にどのようなことがわかってきたのでしょうか。主なテーマごとに、研究結果と実際の治療での活用についてご紹介します。
| トピック | 主な知見 |
| ① PCOS(多嚢胞性卵巣症候群)と腸内環境 | PCOSの女性は「腸内ディスバイオーシス」が起こりやすい インスリン抵抗性や炎症と相関する プロバイオティクスで代謝が改善したという試験も多数 ただし妊娠率や出産率など“生殖の最終アウトカム”への効果はまだ不一致 → PCOSの人は生活習慣+プロバイオティクス併用が“補助的戦略”として有望 |
| ② 体外受精(IVF)と腟・子宮内のマイクロバイオーム | ラクトバチルス優位の女性は妊娠率が高い傾向 ただし研究方法のバラつきが大きく、決定的な結論には至らず 反復着床不全(RIF)への検査・介入は一部で期待されている → 検査は全員に必要ではないが、難治例では検討の価値あり |
| ③ 男性不妊とマイクロバイオーム | 精液中の細菌バランスの乱れが 精子の運動率・形態・DNA損傷と関連 乳酸菌サプリで精液所見が改善した研究もあるが、“妊娠率まで改善”のエビデンスはまだ少数 → まずは生活習慣。その上でプロバイオティクスを“補助的に”! |
| ④ 抗菌薬(抗生物質)の使用と妊娠への影響 | • 妊活中の抗菌薬使用は自然流産のリスクがわずかに上昇する(約1.3〜1.4倍) • 特にトリメトプリムは先天異常との関連が指摘されている • 原因がはっきりしない軽度の子宮内膜炎(CE)に対して抗菌薬単独では妊娠率を改善しなかったとする研究もある → 必要な場面で正しく使うことが大前提。妊活中は特に慎重に選ぶ必要がある。 |
【ARTにおけるマイクロバイオーム介入の可能性】
最近の研究では、腟や子宮内のマイクロバイオームが体外受精(ART)の成績に影響を与える可能性が指摘されています。
特に、ラクトバチルスが多い「良好な腟環境」は妊娠率や着床率と関係するという報告が増えています。
ただし、
- 研究方法の違い
- 検査技術の差
- 小規模研究が多いこと
などから、まだ「標準治療」として確立されているわけではありません。
現時点では、「反復着床不全(RIF)や原因不明不妊の場合に、検査や介入が検討されることがある」という段階です。今後の研究によって、ARTの個別化医療に生かされる可能性があります。
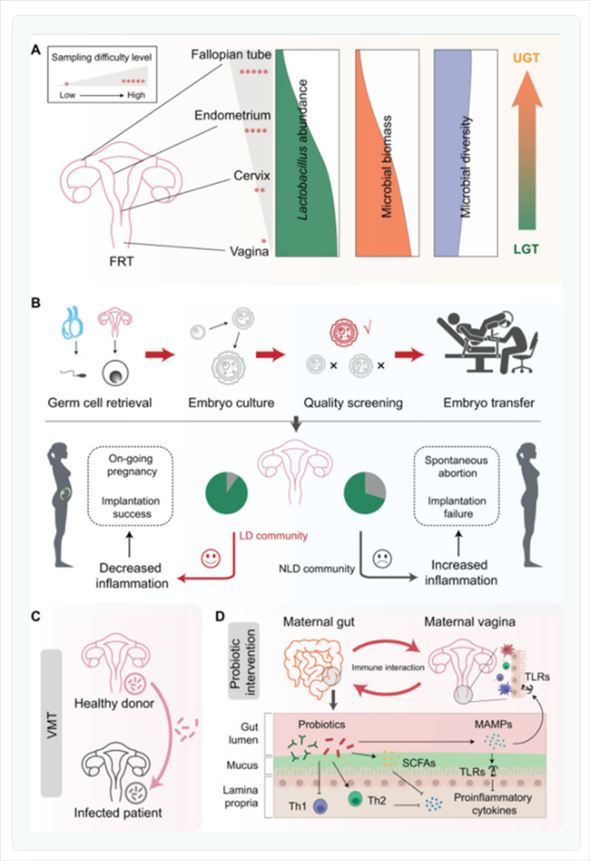
- 女性生殖路におけるマイクロバイオームの違い: 下部生殖路(LGT、腟など)から上部生殖路(UGT、子宮など)に進むにつれて、ラクトバチルス属の割合と微生物バイオマスは急激に減少し、一方で微生物の多様性(アルファ多様性)は増加する。サンプリングの難易度も高くなる。
- IVFの一般的な流れと微生物叢の影響: IVFプロセスでは、採卵、媒精、胚培養・スクリーニングを経て、適切な胚を子宮に移植する。ラクトバチルス優位(LD)の微生物叢は炎症が少なく、より良好なART成績と関連すると考えられている。
- C. VMTによる腟マイクロバイオームの修復: 腟マイクロバイオーム移植(VMT)は、健康なドナーから提供された腟内フローラをレシピエントに移植し、正常な腟内環境を再構築することを目指す新しい治療戦略である。
- D. プロバイオティクス介入と腸–腟間の免疫相互作用: プロバイオティクス、特に乳酸産生菌は、腸と腟の両方で免疫応答を積極的に調節する。これにより、健康な微生物叢をサポートする最適な免疫環境が腟内に作られる。
出典: Xiao L, et al. Genomics Proteomics Bioinformatics. 2024.
AIを使った体外受精成功予測の新しい取り組み
腟内のマイクロバイオームと炎症データをAIに学習させ、体外受精の成功率を予測する研究も登場しています(Bar et al., 2025)。
- ラクトバチルスが多いほど妊娠しやすい
- ガードネレラ菌や炎症マーカーが高いと妊娠成立しにくい
- AIモデルで高い予測精度が得られた
など、マイクロバイオームの“診断ツールとしての可能性”が示されつつあります。
※ただし、臨床応用にはまだ時間が必要です。
マイクロバイオームと生殖医療の研究は、まさに日進月歩で進んでいます。
本記事が、
- 妊活に取り組む方が「自分の体の理解を深める」きっかけに
- 臨床に携わる専門家が「新しい視点を得る」材料に
なれば幸いです。
参考文献
- Baker, J. M., Al-Nakkash, L., & Herbst-Kralovetz, M. M. (2017). The Role of the Gut Microbiota in Female Reproductive and Gynecological Health: Insights into Endometrial Signaling Pathways.
- Salliss, M. E., & Herbst-Kralovetz, M. M. (2023). The Role of the Vaginal and Endometrial Microbiomes in Infertility and Their Impact on Pregnancy Outcomes in Light of Recent Literature.
- Xiao, L., Zuo, Z., & Zhao, F. (2024). Microbiome in Female Reproductive Health: Implications for Fertility and Assisted Reproductive Technologies.
Genomics, Proteomics & Bioinformatics, 22(1), qzad005. https://pubmed.ncbi.nlm.nih.gov/38862423/ - Bar, O., Vagios, S., Barkai, O., et al. (2025). Harnessing vaginal inflammation and microbiome: a machine learning model for predicting IVF success. npj Biofilms and Microbiomes, 11, 95.https://doi.org/10.1038/s41522-025-00732-8