はじめに:なぜ? 年齢とともに妊娠が難しくなる本当の理由
「流産のリスクは、年齢が関係しているらしい」
赤ちゃんを望む多くの女性が、一度は耳にしたことがある言葉ではないでしょうか。
キャリア、パートナーとの時間、そして自分自身の準備。様々なことを考え、いざ「家族を」と思ったとき、この「年齢の壁」という言葉が、漠然とした、しかし確かな重みをもって心にのしかかることがあります。
この感覚は、決してあなた一人だけのものではありません。実際に、女性の年齢が上がるにつれて妊娠率が低下し、流産率が上昇することは、医学的な事実として知られています。
しかし、その背後にある「本当の理由」を、私たちはどれくらい知っているでしょうか。それは単なる体力の問題なのでしょうか。それとも、もっと根源的な、生命の神秘に関わるメカニズムが働いているのでしょうか。
実は、この現象の最も大きな原因の一つは、私たちの目には見えない、非常にミクロな世界で起きています。それは「卵子の質の変化」、そして、より具体的に言えば、生命の設計図である「染色体の数の異常(異数性)」です。
ジョンズ・ホプキンス大学医学部などの専門機関も、加齢に伴う妊娠リスクの上昇の主要因として、胎児の染色体異常を挙げています1。
若い頃は整然と並んでいた設計図が、時とともに少しずつ乱れやすくなる。その結果、胚(受精卵)がうまく育たなかったり、着床しなかったり、あるいは着床しても途中で成長が止まってしまったりするのです。これは誰のせいでもなく、生命が時間を経る中で自然に起こることです。しかし、この科学的な事実を知ることは、漠然とした不安を「理解できる課題」へと変える第一歩となります。
そして現代の生殖医療は、この「染色体異常」という根源的な課題に正面から向き合うための技術を手にしました。その一つが、本記事で詳しく解説する床前胚染色体異数性検査(Preimplantation Genetic Testing for Aneuploidy、略してPGT-A)』です。
この記事では、まず、「年齢」と「染色体異常」がなぜ深く関係するのかを、科学的に分かりやすくひもときます。次に、PGT-Aとは何を調べる検査なのか、分かること・分からないこと、メリットだけでなく課題や注意点も含めて、最新の研究データと専門機関の見解をもとにお伝えします。
この記事が、確かな情報を手がかりに、あなたとパートナーが「自分たちにとっての最善」を選ぶための支えになればと願っています。
第一部:染色体異常と年齢の深い関係
この章では、生命の設計図である染色体の基本的な仕組みを整理しながら、加齢がどのように影響を及ぼすのかを、科学的な視点から解説していきます。
1-1. 生命の設計図「染色体」とその異常
私たちの身体のすべての細胞の核の中には、「染色体」と呼ばれる構造体が存在します。これは、私たちの身体を作るための膨大な情報が書き込まれた「生命の設計図」のようなものです。ヒトの染色体は、通常、22対の常染色体と1対の性染色体(女性はXX、男性はXY)からなる、合計23対46本で構成されています2。
精子と卵子が作られるとき、この対になっている染色体が一つずつに分かれ、それぞれ23本の染色体を持つようになります。そして受精によって再び23対46本の染色体を持つ胚が誕生し、新たな生命が形成されます。この染色体の数が正確であることが、胚が健やかに発育するための絶対的な条件です。
しかし、何らかの理由でこの染色体の数に過不足が生じることがあります。この状態を「異数性(Aneuploidy)」と呼びます。例えば、染色体が1本多い「トリソミー」(ダウン症候群の原因となる21番トリソミーが有名です)や、1本少ない「モノソミー」などです。
異数性は、着床不全や早期流産の主要な原因であると広く認識されています3。異数性を持つ胚の多くは、着床することができません。もしくは、着床しても早い段階で成長を止め、流産に至ります。体外受精で良好な見た目の胚を移植しても妊娠に至らないケースの多くは、この目に見えない染色体異常が関わっていると考えられています。
1-2. 加齢が卵子に与える影響:紡錘体の機能低下
では、なぜ女性の年齢が上がるにつれて、この異数性が増えるのでしょうか。その鍵を握るのが、卵子が成熟する過程で起こる「減数分裂」という細胞分裂と、その分裂を司る「紡錘体(ぼうすいたい)」という細胞内の器官です。
女性の卵子のもとになる細胞(卵母細胞)は、女性が胎児のとき、つまり生まれる前にはすでに一生分が作られており、その中で染色体の最初の分配(第一減数分裂)の準備を終え、長い休眠期間に入ります。そして思春期以降、排卵のたびにこの休眠から目覚め、分裂を再開して成熟した卵子になります。
この分裂の際に、対になっていた染色体を正確に2つに引き離す役割を担うのが、微小管というタンパク質でできた糸が集まってできる「紡錘体」です。若い卵子では、この紡錘体がしっかりと機能し、染色体を中央にきれいに整列させ、均等に分配します。しかし、卵子が年齢を重ねる(=女性自身が年齢を重ねる)と、この紡錘体の機能が低下し、エラーが起きやすくなることがわかっています。
この現象を明確に示した画期的な研究があります。1996年に医学雑誌『Human Reproduction』に掲載された論文で、特殊な顕微鏡を用いて卵子を観察したところ、40~45歳の女性の卵子では79%に紡錘体の異常な配置が見られました。一方、20~25歳の女性の卵子では、染色体の異数性を示す割合は17%にとどまっていたと報告されています4。
このデータは、加齢による卵子の質の変化が、単なる確率論ではなく、細胞レベルでの具体的な機能低下に基づいていることを明確に示しています。
1-3. データで見る年齢と異数性の関係
この細胞レベルでの変化は、実際の体外受精における胚のデータにもはっきりと表れています。年齢とともに、染色体数が正常な「正倍数性胚」の割合は減少し、異常のある「異数性胚」の割合が急激に増加します。
2022年にコロンビアの不妊治療クリニックから発表された研究では、体外受精によって得られ、着床前の段階で染色体数の評価が行われた319個の胚を対象に、母体年齢と異数性率の関係が調査されました。
これらの胚はいずれも、発育が途中で止まったものではなく、臨床的に染色体評価の対象となった胚です。その結果、年齢が上がるにつれて異数性胚の割合は上昇し、40歳以上の女性では72.7%もの胚が異数性であったことが報告されています。これは、40歳を超えると、体外受精で得られた胚の実に4分の3近くが染色体異常を抱えている可能性があることを意味します。
一方で、同研究では35歳未満の患者における正倍数性(正常な染色体数)の割合は37.1%であったと報告されており、異数性胚の割合は約62.9%となります5。
このデータは、高年齢の女性において妊娠率が低下し、流産率が上昇する背景を、染色体レベルから説明しています。たとえ見た目には問題がないような「良好胚」であっても、内部に染色体異常を抱えていれば、妊娠の継続は極めて困難になります。
1-4. 補足:父親の年齢の影響は?
ここまで主に女性の年齢(卵子の年齢)に焦点を当ててきましたが、「父親の年齢はどうなのだろう?」と疑問に思う人もいるでしょう。結論から言うと、胚全体の異数性率(染色体の本数全体の異常)に対して、父親の年齢が与える影響は、母親の年齢に比べて非常に小さいと考えられています。
2020年に『Fertility and Sterility』誌で発表された研究では、若い卵子提供者からの卵子を用いた3,118個の胚を分析した結果、父親の年齢と胚全体の異数性率に関連は見られませんでした。
しかし、この研究では興味深い点も指摘されています。
50歳以上の父親のグループでは、染色体の一部に過不足がある「部分的異数性(segmental aneuploidies)」の発生率が36.6%と、50歳未満の父親のグループ(19.4%)に比べて有意に高かったのです6。 これは、精子の製造プロセス(精子形成)は生涯を通じて続くものの、加齢によりDNAの複製エラーや修復機能の低下が起こりやすくなるためと考えられます。したがって、胚の染色体異常の主要因は母体年齢であるものの、父親の年齢も全く無関係ではない、というのが現在の理解です。

第二部:着床前胚染色体異数性検査(PGT-A)のすべて
第一部では、年齢とともに胚の染色体異常が増加するという、生殖医療が直面する根源的な課題を見てきました。この課題に対する最も先進的なアプローチの一つが、本章の主題である『着床前胚染色体異数性検査(PGT-A)』です。ここでは、PGT-Aがどのような目的で、どのように行われ、何がわかるのかを、順を追って詳しく解説します。
2-1. PGT-Aの目的と歴史:見た目だけではわからない「胚の遺伝的健康」
PGT-Aの根本的な目的は、胚を子宮に移植する前に、その染色体の数に異常がないかをスクリーニングし、染色体数が正常な「正倍数性胚(Euploid embryo)」を選び出して移植することです。これにより、以下の3つの効果が期待できます。
- 妊娠率の向上: 染色体異常を持つ胚は着床しないか、してもすぐに成長を止めてしまうため、それらをあらかじめ避けることで、1回の移植あたりの妊娠成功率を高めることができます。
- 流産率の低下: 妊娠初期の流産の最大の原因は胎児の染色体異常です。正倍数性胚を移植することで、このリスクを大幅に低減させることができます。
- 妊娠までの期間短縮: 染色体異常による移植の不成功や流産を繰り返す心身の負担と時間を減らし、より早く健康な赤ちゃんを授かること(Time to Live Birthの短縮)を目指すことができます。
この技術が登場する前、胚の選択は主に「形態評価」に頼っていました。つまり、顕微鏡で胚の形や成長スピードを観察し、「見た目が美しい」胚を選ぶという方法です。
しかし、米国産科婦人科学会(ACOG)も指摘するように、形態学的に最適な胚を移植しても多くの女性が妊娠に至らないという現実がありました7。その原因が、第一部で見たような「目に見えない染色体異常」だったのです。
この課題を克服するため、着床前の胚を対象に、染色体数や構成を調べる遺伝学的検査の試みが始まりました。初期に用いられていたFISH法では、解析できる染色体が5〜10種類程度に限られていましたが、その後、全染色体を対象とした解析が可能なaCGH法などが登場しました。そして現在では、次世代シーケンシング(Next-Generation Sequencing, NGS)が、PGT-Aの主流の解析技術として用いられています。 PGT-Aは、こうした解析技術の進歩を背景に確立されてきた検査です。
2-2. PGT-Aのプロセス:胚から情報を得る技術
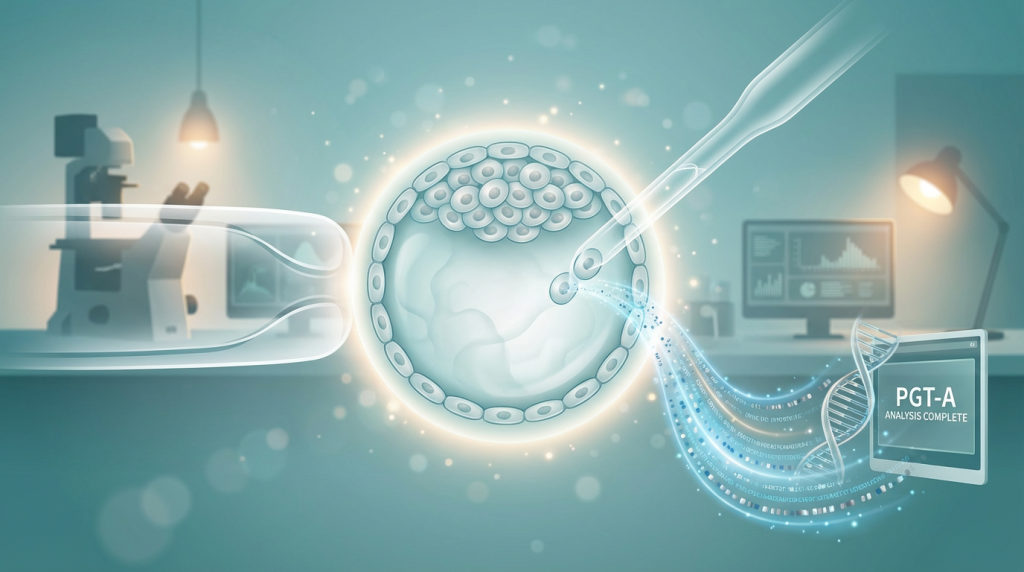
PGT-Aは、大きく分けて「① 胚生検(バイオプシー)」と「② 遺伝子解析」の2つのステップで構成されます。どちらも非常に高度で繊細な技術を要します。
① 胚生検(バイオプシー):胚から細胞を採取する
胚生検とは、遺伝子解析のために胚から数個の細胞を採取する操作のことです。この操作は、胚の発生段階に応じていくつかの方法がありますが、現在、世界的に主流となっているのは「胚盤胞生検(Blastocyst Biopsy)」です。
体外受精によって育てられた胚は、受精後5〜6日目になると「胚盤胞」という状態にまで成長します。胚盤胞は、将来胎児になる細胞の塊である「内部細胞塊(Inner Cell Mass, ICM)」と、その周りを覆い、将来胎盤になる栄養外胚葉(Trophectoderm, TE)」という2つの部分に分かれます。胚盤胞生検では、このTEの一部から、レーザーなどを用いて5〜10個程度の細胞を慎重に採取します。
過去には、受精後3日目の分割期胚から細胞を1つだけ採取する「分割期胚生検」も行われていました。しかし、胚盤胞生検には分割期胚生検に比べて多くの利点があり、現在ではPGT-Aの標準的な手法となっています。欧州ヒト生殖医学会(ESHRE)のPGTコンソーシアムの報告によると、PGT-Aにおける胚盤胞生検の利用率は2018年には98%に達しており、ほぼ完全に標準化されたと言えます8。
- 診断精度の向上: 1細胞しか採取できない分割期胚生検に比べ、5〜10個と多くの細胞を解析できるため、より正確で信頼性の高い結果が得られます。特に、後述する「モザイク」の評価にも有利です。
- 胚へのダメージが少ない: 採取するのは将来胎盤になるTE細胞であり、胎児になるICMを直接傷つけることはありません。研究では、胚盤胞生検が胚の着床能力に悪影響を与えないことが示されています。
② 遺伝子解析:わずかなDNAから全染色体を読み解く
生検で採取されたわずか数個の細胞。その中にある極微量のDNAから、全染色体の情報を正確に読み取るためには、2つの重要な技術が使われます。
・全ゲノム増幅(Whole Genome Amplification, WGA):
まず、解析に必要なDNA量を確保するために、採取したDNAを何百万倍にも増幅します。ただし、この増幅プロセスでエラー(アーティファクト)が生じる可能性もあり、これが後述する診断の限界にも繋がります。
・次世代シーケンシング(Next-Generation Sequencing, NGS):
増幅されたDNAは、NGSという解析装置にかけられます。NGSは、DNAを非
常に短い断片に分解し、それらを同時に、かつ超高速で読み取る技術です。
コンピューターがこれらの断片情報を元の染色体地図と照らし合わせることで、
各染色体が過不足なく存在するか(コピー数)を判定します。NGSは、従来の
aCGH法などに比べて、より小さな染色体断片の異常(部分的異数性)や、正常
細胞と異常細胞が混在する「モザイク」状態を検出する能力に優れています。NGSは、米国生殖医学会(ASRM)の2024年の委員会意見書でも言及されているように、高い処理能力、モザイク胚の検出能力、そして費用の低下により、現在のPGT-Aの標準的な解析技術となっています9。
2-3. PGT-Aの結果の解釈:3つの分類
NGSによる解析の結果、胚は主に以下の3つに分類されます。この結果をもとに、どの胚を移植するかが決定されます。
- 正倍数性胚(Euploid / 正常胚) 染色体の数が23対46本で正常な胚です。これらの胚は、着床・妊娠し、健康な赤ちゃんとして成長する可能性が最も高いと考えられます。したがって、移植の最優先候補となります。
- 異数性胚(Aneuploid / 異常胚) 染色体の数に1本以上の過不足がある胚です。トリソミーやモノソミーなどがこれにあたります。これらの胚は、着床しないか、着床しても流産に至る可能性が極めて高いため、原則として移植には用いられません。
- モザイク胚(Mosaic) 胚の中に、染色体数が正常な細胞と、異常な細胞が一定の割合で混在している状態の胚です。これは、受精後の細胞分裂の過程でエラーが生じることによって発生すると考えられています。NGS技術の感度が向上したことで、この「白黒つけがたいグレーゾーン」の胚が検出されるようになりました。モザイク胚は、その異常細胞の割合によって、さらに「低頻度モザイク」や「高頻度モザイク」に分類されます。これについては、第三部でさらに詳しく掘り下げます。
第三部:PGT-Aの有効性と向き合うべき課題
PGT-Aは、染色体数が正常な胚を見極めるうえで、大きな助けとなる技術です。
一方で、この検査は万能ではなく、結果の受け止め方には慎重さが求められます。メリットだけでなく、技術的な限界や判断の難しさも含めて理解することが重要です。この章では、PGT-Aの有効性をデータで確認しつつ、その課題についても考察します。
3-1. データが示すPGT-Aの有効性
PGT-Aの最大のメリットは、特に母体年齢が高い場合に、移植あたりの妊娠成績を改善し、流産のリスクを低減させる点にあります。この効果は、米国の体外受精(IVF)サイクルの大規模なデータによって裏付けられています。
米国生殖医学会(ASRM)が2024年の意見書で引用した、米国生殖補助技術学会(SART)の2019年の全国データは、PGT-Aの有無による着床率と流産率の違いを年齢層別に示しており、非常に説得力があります10。
着床率の改善: 35歳未満の層では差は比較的小さいですが、年齢が上がるにつれてその差は劇的に開いていきます。特に41-42歳の層では、PGT-Aなしの着床率が17.9%であるのに対し、PGT-Aありでは56.1%と、3倍以上の着床率を示しています。これは、PGT-Aが高年齢層において、妊娠の可能性が低い移植を回避し、効率的に着床へと導く力を持っていることを示しています。
流産率の低下: 同様に、臨床的妊娠(胎嚢が確認された段階)に至った後の流産率も、すべての年齢層でPGT-Aありのグループの方が低く、特に年齢が高い層でその差は顕著です。43歳以上の層では、PGT-Aなしの場合、妊娠しても半数以上(51.5%)が流産に至るのに対し、PGT-Aありでは18.3%にまで抑えられています。これは、妊娠後の喜びが悲しみに変わるという、精神的に最も辛い経験の一つである流産を、PGT-Aが減らす可能性を強く示しています。
これらのデータは、PGT-Aが「移植あたりの成功率」を高め、「流産のリスク」を低減するという点において、特に30代後半以降の女性にとって非常に有効な選択肢となりうることを客観的に示しています。
3-2. 技術的な限界と注意点
一方で、PGT-Aにも限界があります。検査結果は100%確実なものではなく、以下のような不確実性を含む場合があります。
- 偽陽性・偽陰性の可能性: PGT-Aの結果には、「偽陽性(本当は正常なのに異常と判定される)」と「偽陰性(本当は異常なのに正常と判定される)」のリスクが常に伴います。偽陽性は、移植できるはずだった健康な胚を廃棄してしまう「機会損失」に繋がり、偽陰性は、異常な胚を移植してしまい、結果的に着床不全や流産に至る原因となります。
- TEとICMの不一致(生物学的な限界): PGT-Aが抱えるもう一つの根源的な限界は、私たちが検査しているのが、あくまで将来「胎盤」になる栄養外胚葉(TE)の細胞であるという点です。将来「胎児」になる内部細胞塊(ICM)の染色体数と、TEの染色体数が必ずしも一致しない可能性があるのです。ACOGの意見書でも、「モザイクの可能性があるため、TEの検査結果はICMの遺伝的構成を反映していないかもしれない」と指摘されています11。この不一致の存在が、PGT-Aの結果を絶対的な真実としてではなく、「最も可能性の高い状態を示す情報」として捉えるべき理由です。
3-3. 最大の課題:「モザイク胚」との向き合い方
PGT-Aにおける現代の最大の課題は、「モザイク胚」の取り扱いです。NGSの感度向上によって「白黒つけられないグレーゾーン」が見えるようになった結果、私たちは新たな、そして、とても難しい判断を迫られることになりました。
モザイク胚の判断が難しい理由は、その後の運命が予測しきれない点にあります。
- 正常な赤ちゃんとして生まれる可能性がある: 実際に、モザイクと診断された胚を移植し、健康な正倍数性の赤ちゃんが生まれたという報告が多数あります。これは、①胚が成長過程で異常細胞を排除する自己修復メカニズムを持つ②そもそもTEの検査結果がICMの状態を反映していなかった(ICMは正常だった)、などの理由が考えられています。
- 着床率・出産率が低く、流産率が高い傾向にある: 一方で、多くの研究は、モザイク胚の移植は正倍数性胚に比べて、着床率や出産に至る確率が低く、流産率が高い傾向にあることも示しています。2021年のレビュー論文で引用された大規模な研究では、モザイク胚移植後の継続着床率が37%、流産率が25%であったのに対し、正倍数性胚ではそれぞれ77%、7%でした12。
このため、モザイク胚の移植は、他に移植可能な正倍数性胚がない場合の選択肢として考慮されることが一般的です。しかし、どの程度のモザイクなら移植を考慮すべきかなど、まだコンセンサスは確立されていません。したがって、モザイク胚の移植を検討する際には、これらの不確実性について専門家から十分な遺伝カウンセリングを受け、カップルが納得した上で意思決定をすることが極めて重要になります13。
3-4. 「誰にでも有効か?」という議論
PGT-Aが移植あたりの成績を改善する可能性はデータで示されていますが、「では、体外受精を受けるすべての人にとって、PGT-Aは有益なのだろうか?」という問いに対する答えは、実はそれほど単純ではありません。
専門家の間でも、PGT-Aが最終的なゴールである「一回の採卵サイクルあたりの累積出産率(Cumulative Live Birth Rate)」を向上させるかについては、長年議論が続いています。ASRMの2024年の意見書は、複数の信頼性の高い研究をレビューした上で、「すべての不妊患者にPGT-Aを普遍的なスクリーニング検査としてルーチンで使用することは推奨できない」と結論付けています14。
その理由として、以下の点が挙げられます。
- 累積出産率の向上が証明されていない: いくつかの大規模な研究では、PGT-Aを行ったグループと行わなかったグループで、最終的に赤ちゃんを授かる割合に有意な差は見られませんでした。
- 移植キャンセルと機会損失のリスク: PGT-Aを行うと、すべての胚が「異数性」または移植に適さない「高頻度モザイク」と判定され、移植できる胚が一つもなくなってしまうリスクがあります。特に、採卵で得られる胚の数が少ない患者にとっては、このリスクは深刻です。
- コストの問題: PGT-Aは高額な追加費用がかかります。
したがって、PGT-Aを受けるかどうかは、年齢、卵巣予備能、得られる胚の数、経済的要因など、複数の要素を総合的に考慮したうえで行われるべきものです。加えて、「流産リスクの低減」と「移植機会の最大化」のどちらを重視するかという価値観も、重要な判断軸となります。
これらを踏まえ、医師との十分な相談のもとで慎重に決定することが求められます。
第四部:生殖医療の未来と私たち
PGT-Aが現在直面している課題を乗り越えるため、研究者たちは次世代の技術開発に取り組んでいます。 この最終章では、生殖医療の未来を切り拓く可能性を秘めた新しい技術動向と、私たちが考えなければいけない倫理的な側面について探ります。
4-1. より優しく、より正確に:非侵襲的PGT-A(niPGT-A)への期待
現在のPGT-Aが抱える根源的な課題の一つは、胚生検(バイオプシー)という「侵襲的」な手技を必要とする点です。この課題を根本から解決する可能性を秘めているのが、「非侵襲的着床前遺伝子検査(non-invasive PGT-A, niPGT-A)」です。 niPGT-Aは、胚を傷つけることなく、胚が成長する過程で培養液の中に放出した自らのDNAの断片(細胞外DNA, cell-free DNA, cfDNA)を解析する技術です。2025年に発表されたレビュー論文など、多くの研究がその可能性と課題を検討しています [12]。胚へのダメージがないという大きな利点がある一方で、母体由来DNAの混入や解析精度の問題など、臨床応用に向けて解決すべき課題も多く、今後の技術開発が期待されています。
4-2. AI(人工知能)による胚選択の可能性
遺伝子情報とは別のアプローチとして、AI(人工知能)を活用して妊娠の可能性が高い胚を予測する研究も急速に進んでいます。これは、胚を培養するインキュベーターに内蔵されたカメラで連続撮影した「タイムラプス画像」をAIに学習させるというものです。
AIは、人間の目では捉えきれないような、細胞分裂のタイミングやパターンといった微細な特徴を大量に学習し、どの胚が最も良好な発育を遂げ、着床する可能性が高いかを予測するモデルを構築します。
2024年にThe Lancet系列の学術誌『eClinicalMedicine』に掲載されたシステマティックレビューおよびメタアナリシスでは、AIが胚選択における強力な補助的ツールとなる有望な可能性が示されています [13]。将来的には、このAIによる形態・動態評価と、PGT-A(またはniPGT-A)による遺伝子情報を組み合わせることで、より多角的かつ高精度な胚選択が可能になるかもしれません。
4-3. 技術と心:倫理的課題とカウンセリングの重要性
技術の進歩は私たちに新たな選択肢と希望を与えてくれますが、同時に、新たな倫理的な問いも投げかけます。PGT-Aは、その本質が「胚を選別する」という行為であることから、「命の選別につながるのではないか」という懸念が常に議論されます。
どこまでの状態を「異常」とみなし、どこからを「個性」や「多様性」と捉えるのか。モザイク胚のように、将来の可能性が不確かな胚をどう扱うべきか。
これらの問いに、簡単な答えはありません。
だからこそ、技術の進歩以上に重要になるのが、十分な情報提供と遺伝カウンセリングです。ESHREやASRMなどの専門機関は、患者が情報に基づいて自律的な意思決定(インフォームド・デシジョン)を下せるよう、包括的なカウンセリングの重要性を繰り返し訴えています15 16。
技術はあくまでツールであり、それを使うのは私たち人間です。その選択が、カップルにとって真に納得のいくものとなるよう、患者と医療者が対話を重ね、共に考える姿勢が何よりも求められます。
おわりに:情報をもとにあなたらしい選択を
本記事では、年齢と染色体異常の関係を起点に、PGT-Aという技術の役割と、その限界について整理してきました。
PGT-Aは、加齢に伴う染色体異常のリスクに直面するカップルにとって、流産リスクの低減や妊娠までの過程を見直すうえで、有用な選択肢の一つとなります。一方で、この検査は万能ではなく、結果の解釈には慎重さが求められる技術でもあります。
だからこそ、PGT-Aの結果は「妊娠を決める答え」ではなく、「判断を支える重要な情報の一つ」として捉える視点が大切です。
不妊治療の過程では、多くの迷いや不安に直面します。信頼できる情報をもとに、パートナーや医療者と十分に話し合いながら、何を大切にしたいのかを考えていくこと。その積み重ねの中に、それぞれにとって納得できる選択が見えてくるはずです。
参考文献
- Johns Hopkins Medicine. “Advanced Maternal Age.” https://www.hopkinsmedicine.org/health/conditions-and-diseases/advanced-maternal-age ↩︎
- MedlinePlus Genetics. “How many chromosomes do people have?” National Library of Medicine. https://medlineplus.gov/genetics/understanding/basics/howmanychromosomes/ ↩︎
- Cleveland Clinic. “Aneuploidy: Genetic Disorder Causes & Types.” https://my.clevelandclinic.org/health/diseases/24060-aneuploidy
↩︎ - Battaglia, D. E., Goodwin, P., Klein, N. A., & Soules, M. R. (1996). “Influence of maternal age on meiotic spindle assembly in oocytes from naturally cycling women.” Human Reproduction, 11(10), 2217–2222. https://pubmed.ncbi.nlm.nih.gov/8943533/ ↩︎
- Idárraga, G. D. O., et al. (2022). “Results of Preimplantation Genetic Testing for Aneuploidy (PGT-A) in a Cohort of 319 Embryos: Experience in a Fertility Clinic in Colombia.” JBRA assisted reproduction, 26(2), 280–287. https://pmc.ncbi.nlm.nih.gov/articles/PMC9118953/ ↩︎
- Dviri, M., et al. (2020). “Is there a correlation between paternal age and aneuploidy rate? An analysis of 3,118 embryos derived from young egg donors.” Fertility and Sterility, 114(4), 796-803. https://www.sciencedirect.com/science/article/pii/S0015028220303198 ↩︎
- American College of Obstetricians and Gynecologists’ Committee on Obstetric Practice and Society for Maternal-Fetal Medicine. (2020). “Preimplantation Genetic Testing: ACOG Committee Opinion, Number 799.” Obstetrics and Gynecology, 135(3), e133-e137. https://www.acog.org/clinical/clinical-guidance/committee-opinion/articles/2020/03/preimplantation-genetic-testing ↩︎
- Spinella, F., et al. (2023). “ESHRE PGT Consortium data collection XXI: PGT analyses in 2018.” Human Reproduction Open, 2023(2), hoad010. https://pmc.ncbi.nlm.nih.gov/articles/PMC10121336/ ↩︎
- Practice Committees of the American Society for Reproductive Medicine and the Society for Assisted Reproductive Technology. (2024). “The use of preimplantation genetic testing for aneuploidy: a committee opinion.” Fertility and Sterility, 122(3), 421-434. https://www.fertstert.org/article/S0015-0282(24)00241-3/fulltext ↩︎
- Practice Committees of the American Society for Reproductive Medicine and the Society for Assisted Reproductive Technology. (2024). “The use of preimplantation genetic testing for aneuploidy: a committee opinion.” Fertility and Sterility, 122(3), 421-434. https://www.fertstert.org/article/S0015-0282(24)00241-3/fulltext ↩︎
- American College of Obstetricians and Gynecologists’ Committee on Obstetric Practice and Society for Maternal-Fetal Medicine. (2020). “Preimplantation Genetic Testing: ACOG Committee Opinion, Number 799.” Obstetrics and Gynecology, 135(3), e133-e137. https://www.acog.org/clinical/clinical-guidance/committee-opinion/articles/2020/03/preimplantation-genetic-testing ↩︎
- Abhari, S., & Kawwass, J. F. (2021). “Pregnancy and Neonatal Outcomes after Transfer of Mosaic Embryos: A Review.” Journal of Clinical Medicine, 10(7), 1369. https://www.mdpi.com/2077-0383/10/7/1369 ↩︎
- Practice Committees of the American Society for Reproductive Medicine and the Society for Assisted Reproductive Technology. (2020). “Clinical management of mosaic results from preimplantation genetic testing for aneuploidy (PGT-A) of blastocysts: a committee opinion.” Fertility and Sterility, 114(2), 246-254. https://www.fertstert.org/article/S0015-0282(20)30499-4/fulltext ↩︎
- Practice Committees of the American Society for Reproductive Medicine and the Society for Assisted Reproductive Technology. (2024). “The use of preimplantation genetic testing for aneuploidy: a committee opinion.” Fertility and Sterility, 122(3), 421-434. https://www.fertstert.org/article/S0015-0282(24)00241-3/fulltext ↩︎
- Practice Committees of the American Society for Reproductive Medicine and the Society for Assisted Reproductive Technology. (2024). “The use of preimplantation genetic testing for aneuploidy: a committee opinion.” Fertility and Sterility, 122(3), 421-434. https://www.fertstert.org/article/S0015-0282(24)00241-3/fulltext ↩︎
- ESHRE PGT Consortium Steering Committee. (2022). “ESHRE PGT Consortium good practice recommendations for the detection of structural and numerical chromosomal abnormalities.” Human Reproduction Open, 2022(4), hoac044. https://academic.oup.com/hropen/article/2022/4/hoac044/6775986 ↩︎
ドクターコメント
河村寿宏先生より
PGT-Aは、特に35歳以上の女性にとっては、胚移植あたりの妊娠率を上昇させ、妊娠あたりの流産率を明らかに低下させるという大きなメリットがあります。
その一方で、検査結果が100%正しいとは言えないこと、胚への侵襲があること、2026年1月時点では保険適用ではないので高額な費用がかかること、最終的な出産率は明らかに上昇するとは言えないなど、課題も複数もあります。
当院では、臨床遺伝専門医が十分な時間をかけて、ご夫婦にPGT-Aに関する情報提供と遺伝カウンセリングを実施しています。PGT-Aのメリット、デメリットを十分理解した上で、検査を実施するか否かをご夫婦で良くご相談していただく必要があります。
河村寿宏先生プロフィール
田園都市レディースクリニック理事長であり、あざみ野本院の院長を務める河村寿宏先生は、日本の生殖医療をけん引するオピニオンリーダーです。
東京医科歯科大学医学部を卒業後、同附属病院や都立大塚病院での研鑽に加え、デンマーク・コペンハーゲン大学病院への留学で専門性を深められました。帰国後は東京医科歯科大学附属病院産婦人科病棟医長、玉川病院産婦人科医長として不妊専門外来を担当し、2000年に当クリニックを開院されています。
生殖医療専門医・指導医として豊富な経験をもち、国内外の学会でも理事として活躍。
高度生殖医療の分野で多くの患者さんに寄り添いながら、医療の質と温かさを両立させる姿勢が、多くの信頼を集めています。
関連サイト
田園都市レディースクリニック
最新のYoutube動画「郡司りかチャンネル」でのご紹介
https://youtu.be/RggjyRrZa_0?si=Sol1pRu2rj3ywtGK


